جراحی قاعده جمجمه: تکنیکها و خطرات
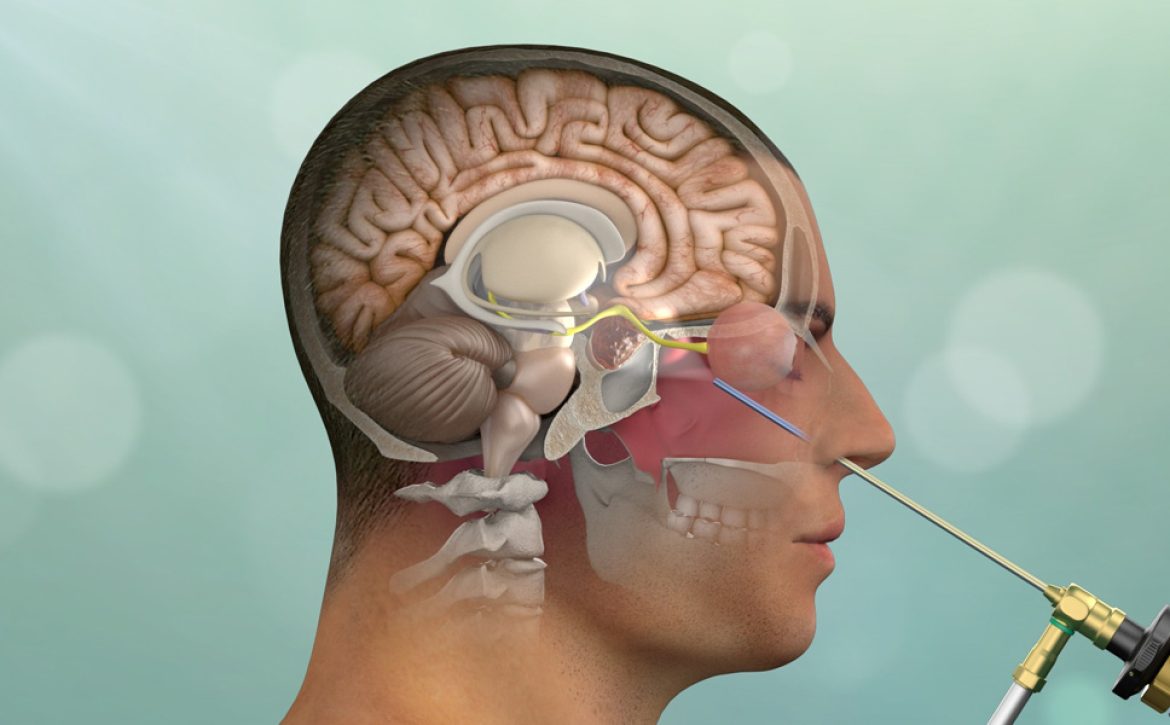
گاهی لازم است تنها چند میلیمتر جلوتر بیاییم تا به دنیایی برسیم که حیات انسان از همانجا فرمان میگیرد. تصور کنید توموری در عمیقترین نقطه مغز رشد کرده است؛ جایی که هیچ جراحی نمیتواند با ابزارهای معمولی نزدیک آن شود، مگر اینکه مسیر باریکی را از دل قاعده جمجمه عبور دهد. این مسیر، چیزی شبیه به یک تونل میکرومتری، پلی است بین دست جراح و ناحیهای که زندگی بیمار در آن تعیین تکلیف میشود. درست در همین فضاست که عصب بینایی، ساقه مغز، عروق حیاتی مثل کاروتید داخلی و شبکههای ظریف عصبی در فاصلهای کمتر از چند میلیمتر از تیغ جراح قرار میگیرند.
در گذشته جراحی این نواحی، تجربهای سنگین و تهاجمی بود؛ برشی بزرگ، دوران نقاهت طولانی و ریسک بالای آسیب به ساختارهای حیاتی. اما ظهور تکنیکهای اندوسکوپیک، چشمانداز درمان تومورهای عمقی را دگرگون کرد. امروز، جراح میتواند بدون شکافتن قطعات وسیع جمجمه، از طریق مسیرهای طبیعی بدن—مانند حفره بینی و سینوس اسفنوئید—مستقیماً به محدوده تومور برسد. همین تحول، جراحی قاعده جمجمه را به نقطهای رسانده که پزشکی کمتهاجمی، نه فقط یک انتخاب، بلکه یک استاندارد جهانی تلقی میشود.
برای آن دسته از بیمارانی که با تومورهای هیپوفیز و تودههای ناحیه سلا مواجه میشوند، مطالعه مقاله تومور هیپوفیز و جراحی آندوسکوپیک مغز میتواند مسیر درک دقیقتری از همین تکنیکها ارائه کند؛ تکنیکهایی که امروز ستون اصلی درمانهای اندوسکوپیک قاعده جمجمه محسوب میشوند.
تعریف و آناتومی قاعده جمجمه
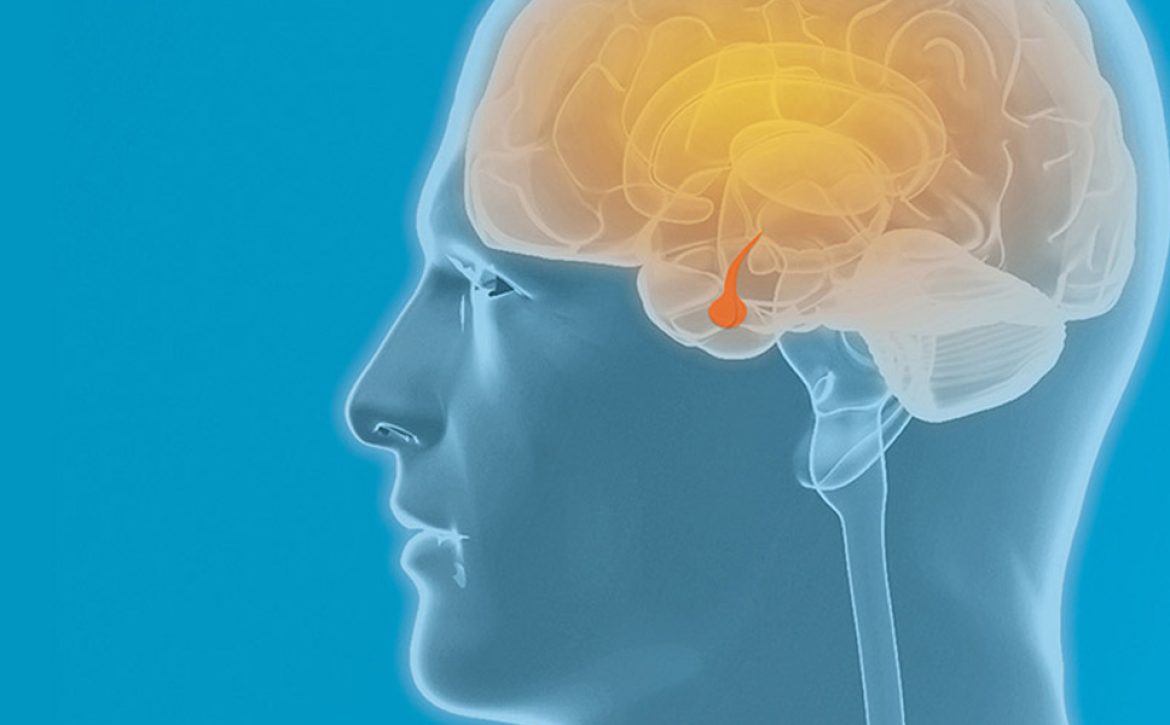
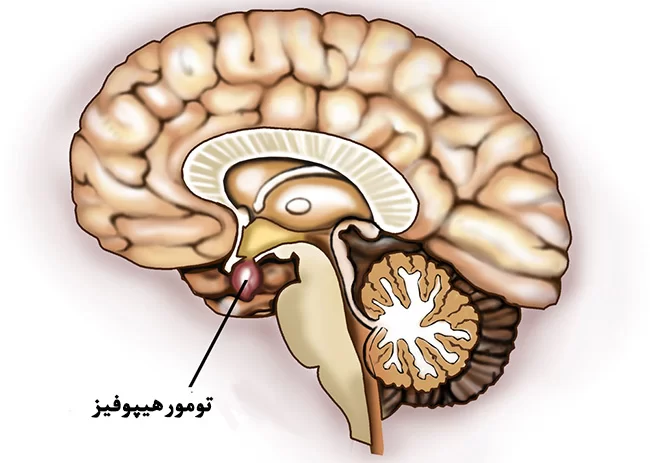
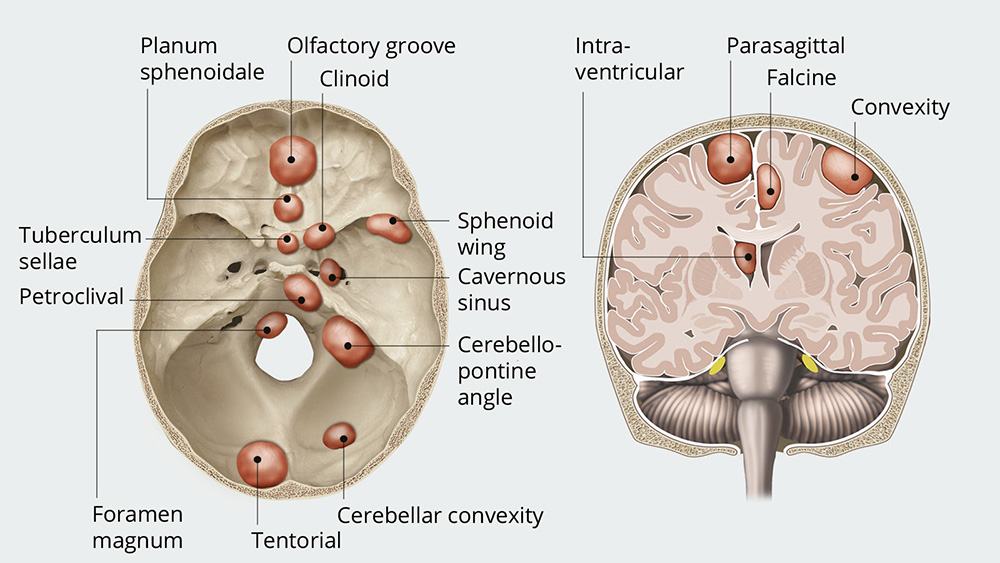
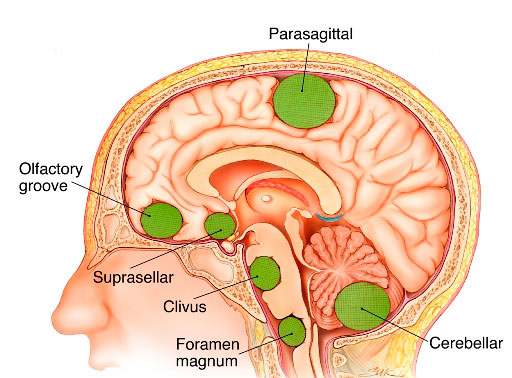
قاعده جمجمه را اگر بخواهیم در یک جمله تعریف کنیم، باید بگوییم: مرزی ظریف، پیچیده و چندلایه که مغز را از ساختارهای صورت و گردن جدا میکند. این بخش از جمجمه از ناحیه کلویید در عقب شروع میشود و تا زایده پتریگوئید در جلوی صورت امتداد پیدا میکند؛ محدودهای که مانند یک سکو، مغز را روی خود نگه میدارد و در عین حال گذرگاه صدها مسیر عصبی و عروقی است.
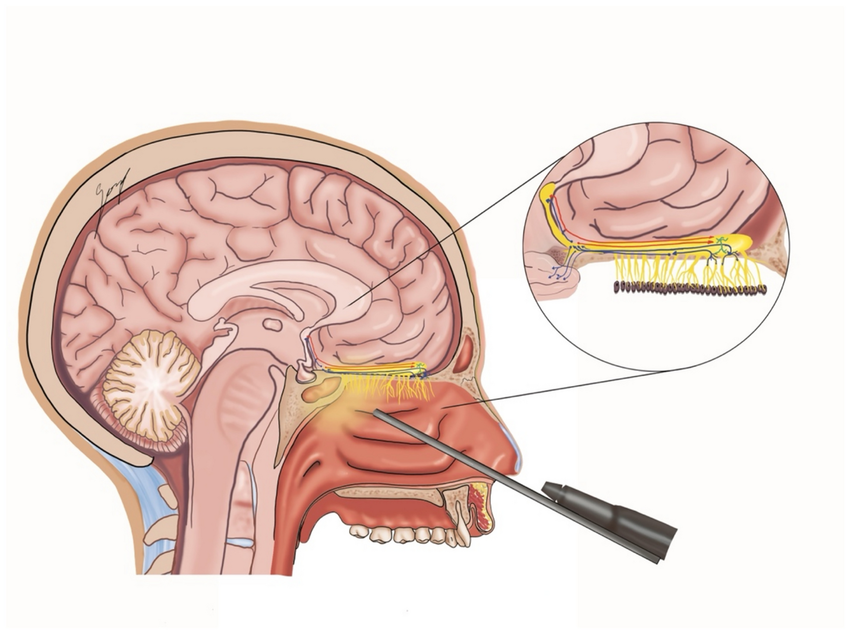
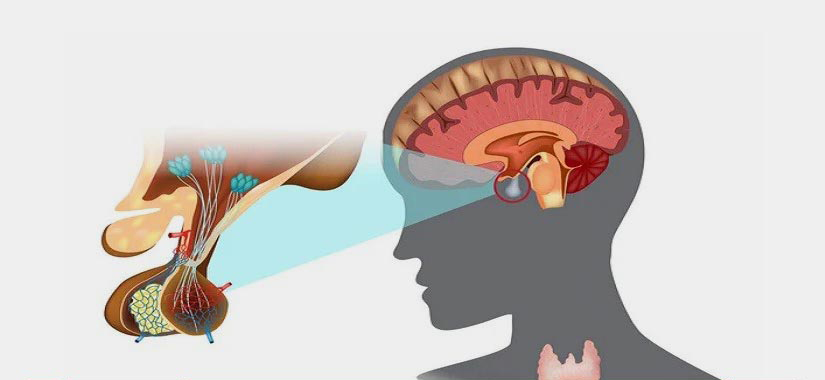
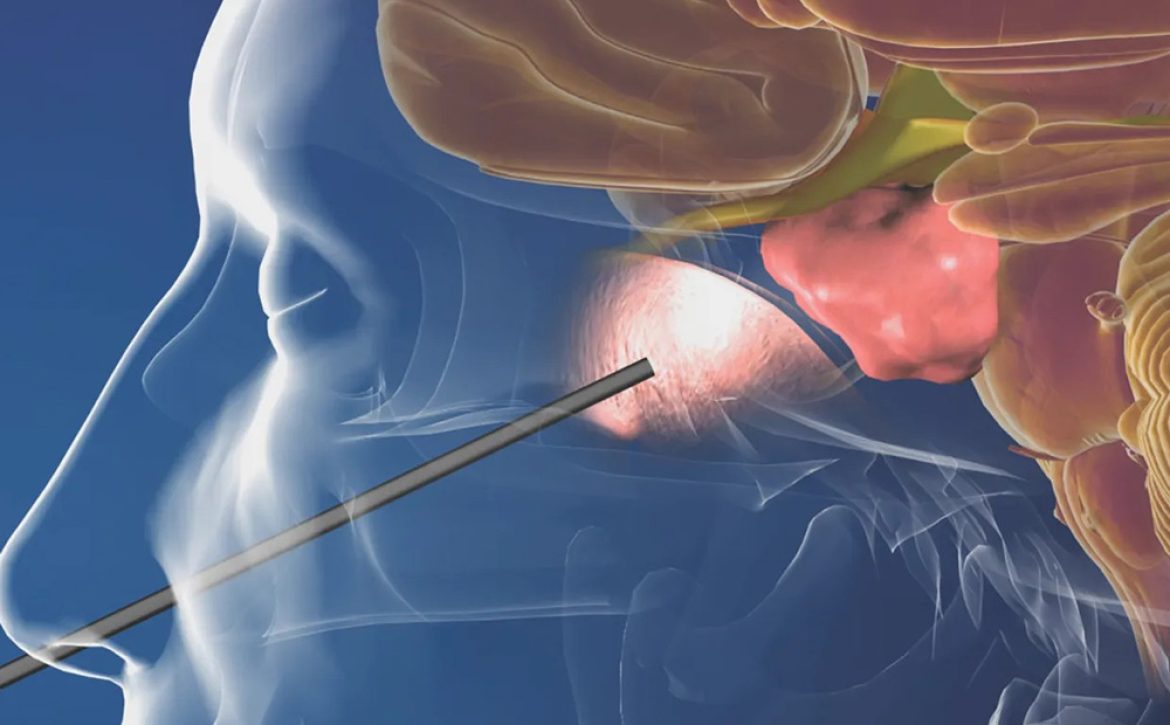
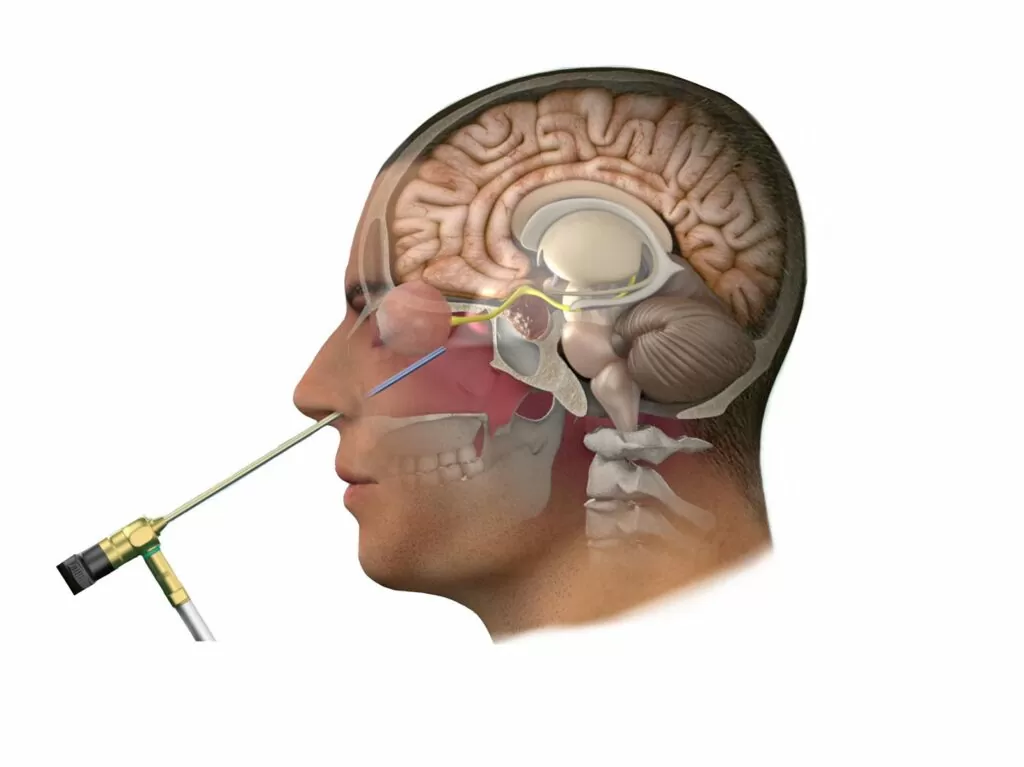
جراحان معمولاً این ناحیه را به چند مسیر اصلی دسترسی تقسیم میکنند. رایجترین و شناختهشدهترین مسیر، ترانساسفنوئیدال است؛ مسیری که از طریق بینی و سینوس اسفنوئید طی میشود و بیشترین کاربرد را در خارج کردن تومورهای هیپوفیز دارد. دقیقاً از همین راه است که جراح میتواند بدون هیچ برش خارجی، به ناحیه سلا برسد و تومور را با حداقل دستکاری ساختارهای اطراف بردارد.
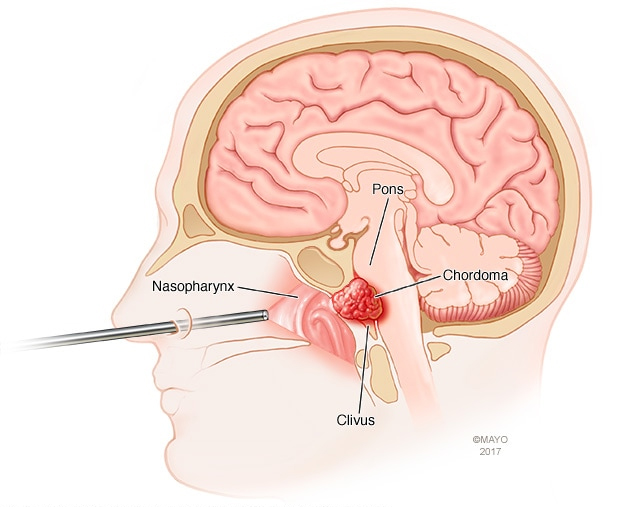
مسیرهای دیگر، مانند ترانزتوبروکولوم و ترانزکلویید، بیشتر در تومورهایی مثل مننژیوما، کوردوما و تودههای عمقیتر استفاده میشوند. این مسیرها عمدتاً در نواحی بالاتر و نزدیکتر به عصب بینایی و شاخههای اصلی کاروتید داخلی قرار دارند؛ جایی که کوچکترین حرکت، میتواند بر بینایی، تعادل، هوشیاری یا حتی حیات بیمار اثر بگذارد.
در اطراف این فضا، ساختارهایی چون عصبهای بینایی، سینوس کاورنوس، هیپوفیز، ساقه مغز و شبکه پیچیدهای از شریانها و وریدها قرار گرفتهاند. اگر این ناحیه را روی یک صفحه تصور کنیم، شبیه یک نقشه سهبعدی است که هر لایهاش نقش حیاتی دارد. مسیر آندوسکوپ از میان بینی وارد سینوس اسفنوئید میشود، سپس از دیواره قدامی سلا عبور میکند و در نهایت به نقطهای میرسد که جراح بتواند تومور را زیر دید مستقیم خارج کند. این مسیر، در عین ظرافت، یکی از قدرتمندترین دستاوردهای جراحی مدرن است.
انواع تومورها و ضایعات شایع در قاعده جمجمه
وقتی درباره قاعده جمجمه حرف میزنیم، در واقع از یکی از شلوغترین و حیاتیترین چهارراههای بدن صحبت میکنیم؛ جایی که هر میلیمترش مسیر عبور عصب، رگ، غده یا بافت مهمی است. به همین دلیل، کوچکترین ضایعهای که در این ناحیه شکل میگیرد، میتواند شرححال بیمار را از یک سردرد ساده تا تغییر بینایی یا اختلال هورمونی تغییر دهد. شایعترین تودههایی که جراحان در این محدوده با آنها روبهرو میشوند، معمولاً با یک الگوی مشخص خود را نشان میدهند؛ اما هر بیمار داستان خودش را دارد.
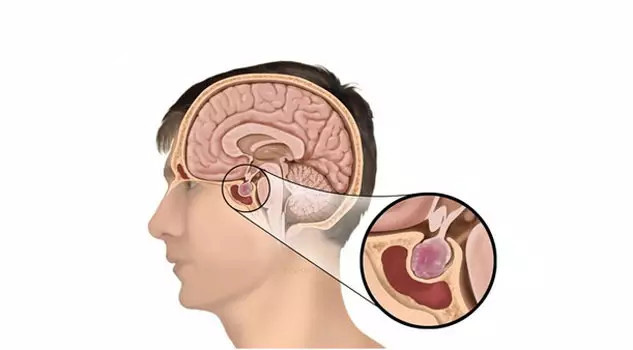
در رأس این فهرست، تومورهای غده هیپوفیز قرار دارند؛ تودههایی که در اغلب موارد خوشخیماند اما اثرشان بر بدن شاید از بسیاری از تومورهای بدخیم هم شدیدتر باشد. چه پرولاکتینوما باشد، چه آدنوم ACTH یا GH، اولین نشانه معمولاً یا تغییرات هورمونی است یا اختلال بینایی. این همان توموری است که جراحی اندوسکوپیک ترانساسفنوئیدال برایش تبدیل به استاندارد جهانی شده است.
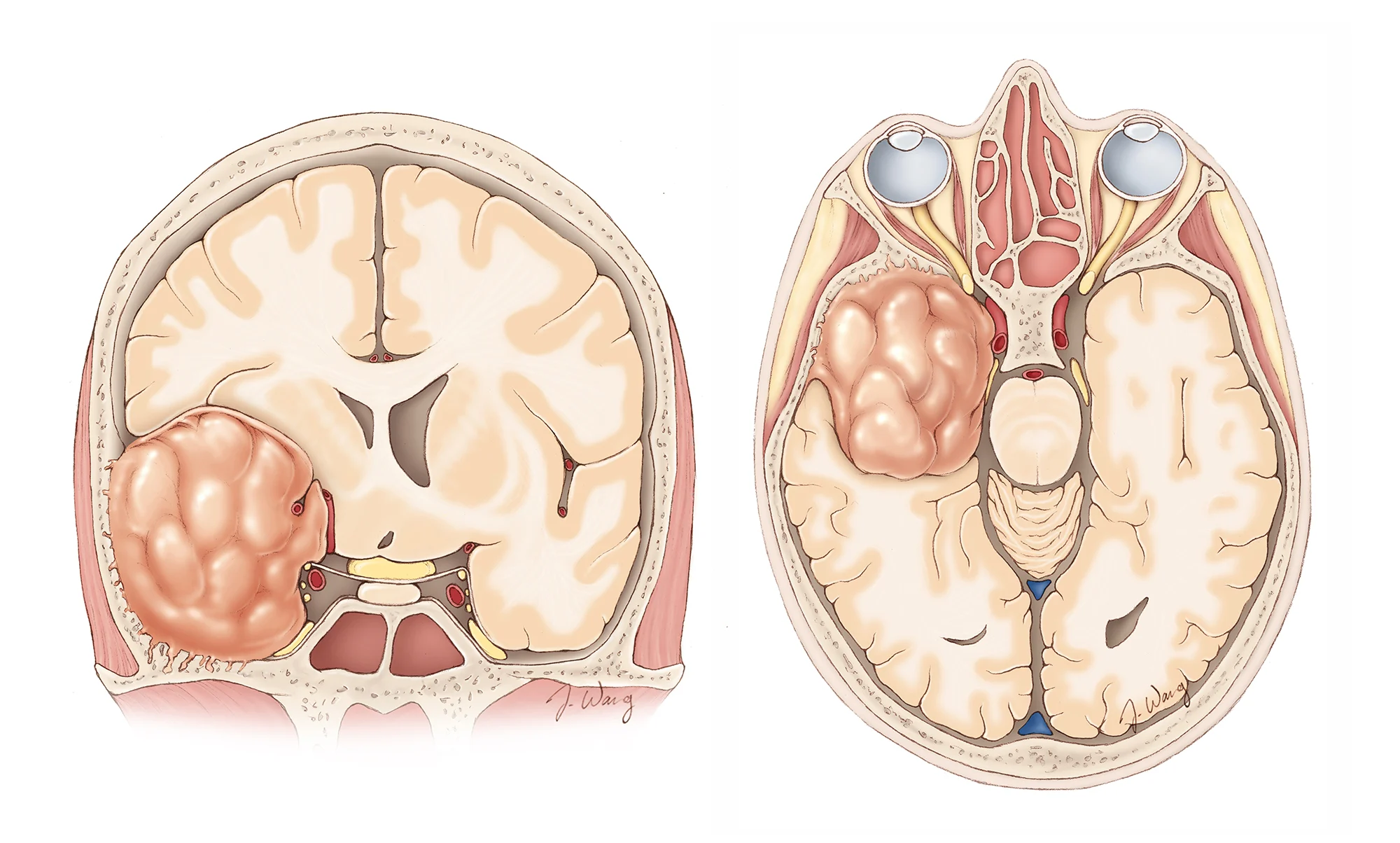
در کنار هیپوفیز، مننژیوماها یکی از پرتکرارترین مهمانان ناخوانده قاعده جمجمه هستند. این تودهها معمولاً آرام رشد میکنند اما همین رشد آهسته، آنها را بهمرور به ساختارهایی میرساند که نزدیک شدن به آنها پر از ریسک است؛ مثل عصب بینایی یا شریان کاروتید. در مقابل، کوردوماها سرسختترند؛ تومورهایی عمیق، استخوانی و نیازمند جراحیهای دقیق چندمرحلهای.
کرانیوفارنژیوماها داستان متفاوتی دارند. تودههایی که میان مغز و غده هیپوفیز قرار میگیرند و معمولاً بیماران جوانتر درگیرشان میشوند. اغلب کیستیک، مزاحم، و نیازمند مدیریت بسیار ظریف.
شوانوماها نیز از دیگر تودههایی هستند که از غلاف عصبی منشأ میگیرند و بسته به عصب درگیر، علائم متفاوتی ایجاد میکنند.
در این میان، آدنومهای غیرکارکردی هم هستند که هیچ هورمونی ترشح نمیکنند و دقیقاً به همین دلیل دیر کشف میشوند؛ معمولاً وقتی که سایزشان به حدی رسیده که مسیر دید بیمار را مختل کرده است.
نباید تومورهای متاستاتیک را نادیده گرفت. هرچند کمتر از ساختارهای اولیه دیده میشوند، اما وقتی در قاعده جمجمه قرار میگیرند، تشخیصشان در MRI نیاز به دقت فوقالعادهای دارد. سیگنالهای نامنظم، واکنشهای التهابی اطراف، و تفاوت الگوی رشد آنها از ویژگیهایی است که جراحان و رادیولوژیستها با دقت آن را بررسی میکنند.
برای درک بهتر آینده درمان برخی از این تومورها، مطالعه مقاله مرتبط ژنتراپی در تومورهای مغزی: امید تازه میتواند تصویر متفاوتی از مسیرهای نوین درمانی ارائه دهد.
روشهای جراحی قاعده جمجمه
در نگاه اول شاید تصور کنید جراحی قاعده جمجمه یک مسیر مشخص دارد، اما در عمل، هر ضایعه میتواند دهها مسیر، زاویه و تکنیک متفاوت را طلب کند. اینجا همانجایی است که تجربه جراح، ظرافت تکنیک و انتخاب درست مسیر دسترسی اهمیت پیدا میکند.
روشهای کلاسیک (باز و میکروسکوپیک)
سالها پیش، زمانی که ابزارهای اندوسکوپیک هنوز نمیتوانستند با کیفیت امروزی به ناحیههای عمقی دسترسی پیدا کنند، جراحی باز تنها گزینه بود. در کرانیوتومی سنتی، جراح با ایجاد یک پنجره استخوانی بزرگ وارد فضای جمجمه میشد تا بتواند از بالا یا کنار مغز خود را به تومور برساند. مزیت این روش، دید وسیع و امکان کنترل مستقیم روی توده بود؛ اما بهایش چه بود؟
ورود به بافتهای سالم، جراحت بیشتر، احتمال تورم مغز، و دوران نقاهت طولانیتر.
در مسیرهای باز خاص، مثل لامینا ترمینالیس یا بیزال اکسس، جراح عملاً به نواحی عمیقتر نزدیک میشد اما همچنان محدودیت بزرگی وجود داشت: عبور از بافتهای حیاتی برای رسیدن به ضایعه.
با ظهور نسل جدید ابزارهای تصویربرداری و میکروسکوپهای قویتر، این روشها بهتدریج محدود به تومورهایی شدند که ساختمانشان اجازه عبور از مسیر اندوسکوپیک را نمیدهد.
جراحی اندوسکوپیک قاعده جمجمه (Endoscopic Skull Base Surgery – ESBS)
در دنیای امروز جراحی اعصاب، اندوسکوپی نه یک تکنیک جانبی بلکه یک انقلاب محسوب میشود. در این روش، جراح بدون باز کردن جمجمه، از طریق حفره بینی و با یک آندوسکوپ HD وارد میشود و تمام مسیر را روی مانیتور با وضوح بالا میبیند؛ وضوحی که حتی گاهی بیش از دید مستقیم چشم است.
ورود با آندوسکوپ نهتنها میزان جراحت را به حداقل میرساند، بلکه به جراح اجازه میدهد با زاویههای مختلف، پشت توده، کنارهها و حتی مناطقی را ببیند که در جراحی باز دیده نمیشود.
مراحل جراحی اندوسکوپیک معمولاً به ترتیب زیر پیش میرود، اما روایت انسانیاش چیزی فراتر از یک فهرست است:
• ناوبری عصبی (Neuronavigation): پیش از ورود آندوسکوپ، سیستم ناوبری مانند GPS مسیر جراح را مشخص میکند. تصویر سهبعدی از بیمار روی صفحه ظاهر میشود و با دقت میلیمتری نشان میدهد که نوک ابزار در کدام نقطه از مسیر قرار دارد.
• ورود به سینوس اسفنوئید: جراح از طریق بینی وارد میشود و به آرامی دیوارههای داخلی را کنار میزند تا به حفره اسفنوئید برسد؛ مثل باز کردن یک در پنهان که راه را به قاعده جمجمه باز میکند.
• دستیابی به تومور: پس از باز کردن دیواره استخوانی، جراح به توده میرسد. در این مرحله هر حرکت مانند حرکتی روی یخ نازک است؛ زیرا کاروتید داخلی، عصبهای بینایی و شبکههای عصبی فقط چند میلیمتر فاصله دارند.
• برداشت تومور و پاکسازی حاشیهها: ابزارهای ریز و ظریف وارد میدان میشوند. بسته به نوع تومور، ممکن است بخش جامد، کیستیک یا بافت فیبری برداشته شود. جراح معمولاً از زوایای مختلف آندوسکوپ استفاده میکند تا گوشههای پنهان را هم کامل پاکسازی کند.
• بازسازی: پس از برداشت توده، فضای ایجادشده باید ترمیم شود. یکی از روشهای استاندارد استفاده از فلپ نازوسپتوم یا پریکوست است که مانند یک وصله طبیعی عمل کرده و مانع نشت CSF میشود.
• درناژ CSF: اگر فشار مایع مغزی نخاعی زیاد باشد یا احتمال نشت وجود داشته باشد، برای چند روز یک درناژ موقت قرار داده میشود تا روند ترمیم کامل شود.
در توصیف این مراحل، تصویرسازی ذهنی خود به خود شکل میگیرد: تونلی باریک، نور آندوسکوپ، بافتهای ظریف اطراف، و تیمی که در هماهنگی کامل، قدمبهقدم تومور را از میان ساختارهای حیاتی جدا میکند.
ابزارها و تکنولوژیهای نوین مورد استفاده
اگر چند دهه به عقب برگردیم و اتاق عمل جراحی اعصاب را با امروز مقایسه کنیم، تفاوتی میبینیم که شاید در هیچ حوزهی دیگر پزشکی به این سرعت رخ نداده باشد. امروز، تکنولوژی بهقدری با جراحی قاعده جمجمه درآمیخته که عملاً بدون آن نمیتوان حتی یک مورد استاندارد هیپوفیز را با ایمنی کافی انجام داد. هر ابزار، بخشی از یک پازل پیچیده است که قرار است جراح را در محیطی هدایت کند که میلیمترها تعیینکننده نتیجه هستند.
یکی از ستونهای این تحول، سیستمهای ناوبری سهبعدی (3D Navigation Systems) است. در ظاهر، نوعی مانیتور در کنار جراح قرار دارد؛ اما در واقع، این دستگاه همان نقش GPS را بازی میکند. هر ابزار وارد اتاق عمل که میشود، در صفحه نمایش جای دقیقی در ساختار جمجمه پیدا میکند. وقتی جراح میخواهد وارد سینوس اسفنوئید شود، ناوبری دقیقاً نشان میدهد چند میلیمتر تا عروق کاروتید فاصله دارد، یا سقف سلا در کدام زاویه نازکتر است. این دقت، همان چیزی است که امروزه جراحی قاعده جمجمه را به کاری قابل پیشبینیتر و کمخطرتر تبدیل کرده.
در ادامهی این مسیر، اندوسکوپهای HD و 4K قرار میگیرند؛ ابزارهایی که به جرأت میتوان گفت چشم دوم جراح هستند. تصویری که این اندوسکوپها ثبت میکنند، وضوحی دارد که حتی دید مستقیم چشم انسان نیز نمیتواند به آن برسد. همانجا که در روش باز، گاهی سایهی یک بافت مانع دید میشد، اندوسکوپ با زاویهی ۳۰ یا ۴۵ درجه فضا را شفاف میکند. کانالهای باریک، پشت تومور، دیوارهی سینوس کاورنوس—همه با وضوحی قابل لمس دیده میشوند.
برای ارزیابی جریان خون و تشخیص دقیق حدود عروقی، فلورسنت ایمیجینگ (ICG) وارد میدان میشود. تزریق یک مادهی فلورسنت و روشن کردن ساختارهای عروقی زیر نور مخصوص، به جراح نشان میدهد که دقیقاً کدام رگها زنده، شریانها سالم و خونرسانی کافی است. این تکنیک مخصوصاً در جراحیهایی که تومور به کاروتید یا شاخههای کوچک آن نزدیک شده، حکم چراغقوهای را دارد که مرزهای امن را مشخص میکند.
در مرحله برداشت تومور، ابزارها پیچیدهتر و حساستر میشوند. لیزر آبلیشن در جراحیهای تومورهای فیبری یا عمیق، به جراح اجازه میدهد با گرمای کنترلشده، بافتهای اضافی را بردارد بدون اینکه ساختارهای حساس اطراف آسیب ببینند. در کنار آن، اولتراسونیک اسیپریتور مانند یک مکش هوشمند عمل میکند؛ توده را لایهبهلایه میتراشد و خارج میکند، بدون اعمال فشار اضافه روی بافتهای عصبی.
در نهایت، بازسازی ناحیه مرحلهای است که ظرافت ابزارهای میکروسرجیکال معنا پیدا میکند. چه بازسازی دیوارهی سلا باشد، چه تقویت لایههای مننژ، یا ترمیم یک رگ کوچک؛ این ابزارها همان نقش سوزنهای ریز در هنر خوشدوزی دارند. نتیجهی استفاده صحیح از این تکنیکها، کاهش خطر نشت CSF، بازگشت سریعتر بیمار به زندگی و کاهش عوارض پس از عمل است.
یکی از زیباییهای جراحی قاعده جمجمه همین است: ترکیب عقل جراح، سالها تجربه، و تکنولوژیهایی که هرکدام مانند قطعهای از یک ارکستر عمل میکنند.
مراحل قبل از عمل و ارزیابیهای پیشجراحی
همیشه باور دارم که نتیجهی یک جراحی قاعده جمجمه—چه هیپوفیز باشد، چه مننژیوما، چه تومورهای عمقیتر—از هفتهها قبل از ورود بیمار به اتاق عمل تعیین میشود. مرحله پیشجراحی، بخش پنهان اما شاید مهمترین رکن کل فرایند است. اینجاست که داستان هر بیمار از یک تصویر MRI ساده به نقشهای چندبعدی تبدیل میشود.
ارزیابی تصویربرداری معمولاً با MRI با پروتکلهای تخصصی آغاز میشود. تصاویر T1، T2، FLAIR، Dynamic Contrast و sequences مخصوص قاعده جمجمه کمک میکنند تا مشخص شود تومور از کجا منشأ گرفته، نسبتش با عصب بینایی چطور است، و آیا به سینوس کاورنوس فشار وارد میکند یا نه. در مواردی که خطر درگیری عروقی وجود دارد، MR Angiography یا حتی CT Angiography بهصورت مکمل استفاده میشود تا مسیر دقیق شریانها و وریدها مشخص شود. این اطلاعات بعداً در سیستم CT‑Navigation وارد میشود تا جراح در زمان عمل، دقیقاً روی نقشهای کار کند که از پیش رسم شده.
از نظر بالینی، همکاری تیمی اهمیت زیادی دارد. مشاوره نورولوژی معمولاً برای ارزیابی وضعیت عصبی بیمار انجام میشود؛ آیا میدان دید در طرفین محدود شده؟ آیا سردردهای فشاری جدید ظاهر شده؟ آیا ضعف هورمونی ناشی از فشار بر هیپوفیز وجود دارد؟
از طرف دیگر، متخصص ENT نقش کلیدی در تعیین مسیر اندوسکوپ دارد. او وضعیت تیغهی بینی، سینوزیتهای پنهان، انحراف، پلیپ یا هر عامل دیگری را بررسی میکند که میتواند روی مسیر ورود اندوسکوپ اثر بگذارد. در مواردی، یک آندوسکوپی اولیه جهت آمادهسازی مسیر سینوسی ضروری است تا هنگام جراحی، مسیر ورود کاملاً باز و بدون مانع باشد.
مسائل عمومی سلامت نیز نادیده گرفته نمیشود. کنترل دقیق فشار خون، قند خون، وضعیت قلبی و ریوی، بررسی داروهای مصرفی، و حتی سطح ویتامین D در برخی بیماران انجام میشود. هرچقدر شرایط بیمار پایدارتر باشد، جراحی با ایمنی بیشتری پیش خواهد رفت.
در نهایت، نوبت به برنامهریزی بیهوشی میرسد. جراحی قاعده جمجمه مانند بسیاری از جراحیهای دیگر نیست. تیم بیهوشی باید آماده باشد که در زمان برداشت تومور، کوچکترین تغییر در فشار داخل جمجمه یا حجم خونرسانی را مدیریت کند. به همین دلیل، بیهوشی عمومی با مانیتورینگ پیشرفته انجام میشود. کنترل فشار CO2، کنترل دقیق مایعات، و حفظ یک میدان جراحی خشک و پایدار، نقش کلیدی در موفقیت جراحی دارند.
این مسیر مقدماتی، فقط یک روند اداری یا تکمیلی نیست؛ بلکه زیرساختی است که جراحی بر آن استوار میشود. هر بخش کوچک از این مرحله، یکی از آجرهای دیواری است که در نهایت ایمنی و نتیجهی عمل را تضمین میکند.
مراقبتهای حین عمل و نکات حیاتی جراحی
وقتی جراح وارد مرحلهی اصلی عمل میشود، فضای اتاق عمل برای چند ساعت شبیه یک صحنهی کاملاً هماهنگ و پرتمرکز است؛ هر عضو تیم میداند که کوچکترین مکث یا حرکت، میتواند در ناحیهای که تنها چند میلیمتر با شریان کاروتید یا عصب بینایی فاصله دارد، اثر بزرگی بگذارد. جراحی قاعده جمجمه، بیش از آنکه یک «اقدام تکنیکی» باشد، یک هنر است—ترکیبی از دقت، پیشبینیپذیری و آرامش.
در این مسیر، نخستین اصل، حفظ دید شفاف است. اندوسکوپ مانند چشم دوم جراح عمل میکند؛ اما این چشم، همانقدر که توانمند است، حساس هم هست. خونریزیهای ظریف سینوسی، بخار حاصل از ابزارهای حرارتی، یا حتی قطرات ریز مخاط میتواند بهسرعت شفافیت تصویر را مختل کند. به همین دلیل، دستیار جراح مدام مسیر اندوسکوپ را پاک میکند، لنزها را گرم نگه میدارد تا بخار ننشیند، و با تغییر زاویه آندوسکوپ، خط دید را بهصورت لحظهای تنظیم میکند. حفظ این شفافیت، در حقیقت ستون فقرات ایمنی عمل است.
از سوی دیگر، مدیریت خونریزی مهمترین عاملی است که اجازه میدهد جراح بدون اضطراب به توده نزدیک شود. در اندوسکوپی، خونریزی معمولاً «سطحی» است و با Coagulation ملایم کنترل میشود تا هم میدان دید باز بماند، هم حرارت اضافه به اعصاب یا عروق نزدیک منتقل نشود. هر نقطهی خونریزی باید آرام، دقیق و بدون اعمال انرژی گسترده بسته شود. اعمال انرژی زیاد، میتواند بهسادگی به دیوارهی کاروتید یا اعصاب حرکتی چشم آسیب برساند—اتفاقی که هیچ جراحی حتی نمیخواهد تصورش را کند.
اما شاید حساسترین بخش جراحی، پرهیز از تماس با اعصاب کرانیال II، III و VI است؛ اعصاب بینایی، حرکت چشم و تطابق چشمی. در ناحیه سلا و سینوس کاورنوس، این عصبها مانند رشتههای ظریف نور کنار توده قرار دارند. هر حرکت ابزار در این منطقه باید با نوعی احترام و احتیاط انجام شود. جراح اغلب بهجای «کشیدن» بافت، آن را «جابهجا» میکند؛ بهجای فشار، از حرکات میکرومتری استفاده میکند. همین ریزهکاریهاست که باعث میشود بیمار بعد از عمل بدون دوبینی یا تاری دید از تخت جراحی بلند شود.
و در پایان این مسیر حساس، احتمال تماس با CSF موضوعی است که همیشه در ذهن جراح حضور دارد. اگر حتی مقدار کمی از مایع مغزی–نخاعی از لایه دورا عبور کند، باید بلافاصله ترمیم شود. این ترمیم معمولاً با استفاده از یک Graft کوچک (مثلاً پریکوست یا لایهی نازکی از غضروف سپتوم) و در صورت نیاز Sealant انجام میشود. این کار فقط یک اقدام تکنیکی نیست؛ بلکه تصمیمی استراتژیک برای جلوگیری از عفونتهای خطرناکی مثل مننژیت و جلوگیری از نیاز به عمل مجدد.
در مجموع، لحظات حین عمل، لحظاتی هستند که جراحی قاعده جمجمه را از یک کار روتین به کاری هنرمندانه و مبتنی بر تجربه تبدیل میکند؛ تجربهای که هر بیمار انتظار دارد جراحش به آن مسلط باشد.
مراقبتهای بعد از جراحی (Post‑Op Care)
وقتی عمل به پایان میرسد و بیمار از اتاق عمل خارج میشود، کار جراح تمام نشده است؛ در حقیقت، نیمهی دوم درمان از همین لحظه آغاز میشود. مراقبتهای پس از جراحی قاعده جمجمه، مرحلهای تعیینکنندهاند؛ چرا که این ناحیه، نقطهای است که کوچکترین نشت، التهاب یا عفونت میتواند پیامدهای مهمی داشته باشد.
معمولاً بیمار ابتدا ۲ تا ۳ روز در یک ICU سبک بستری میشود؛ بخشی که نه به اندازه ICU عمومی شلوغ و پرتنش است و نه به اندازه بخشهای عمومی ساده. فشار خون، سطح هوشیاری، میزان خروج ترشحات بینی، و نشانههای احتمالی نشت CSF هر چند ساعت پایش میشود. بیشتر بیماران در همین چند روز از نظر وضعیت عصبی پایدار میشوند و درد خاصی تجربه نمیکنند.
یکی از مهمترین نکاتی که همیشه به بیماران گوشزد میشود، پرهیز از فین کردن، عطسه با دهان بسته، یا وارد کردن هرگونه فشار به بینی است. این قوانین ساده به ظاهر، نقش بزرگی در پیشگیری از CSF Leak دارند. حتی یک فین شدید میتواند بخیههای داخل بینی یا لایهی بازسازیشدهی سلا را جابهجا کند.
در ادامه، برای تسریع ترمیم مسیر سینوسی و کاهش التهاب، معمولاً اسپری سالین (شستوشوی آبنمک ایزوتون) توصیه میشود. این شستوشو اجازه میدهد لختهها، ترشحات و خشکیهای ناشی از جراحی بهمرور از بین بروند. در صورت نیاز، آنتیبیوتیک موضعی نیز تجویز میشود تا مسیر جراحی در برابر عفونت مقاوم بماند.
پیگیریهای تصویربرداری بخش دیگری از مراقبت است. معمولاً MRI کنترل پس از ۳ ماه انجام میشود تا وضعیت ناحیه جراحی، میزان برداشت تومور، و روند بازسازی بررسی شود. بعد از آن، بیمار وارد برنامهی پیگیری بلندمدت هر ۶ ماه میشود؛ چرا که برخی تومورها، مانند کرانیوفارنژیوما یا آدنومهای غیرکارکردی، رفتار غیرقابلپیشبینی دارند و ممکن است سالها بعد عود کنند.
مدیریت و مراقبت پس از جراحی تومور هیپوفیز
میتواند کمک کند تصویر کاملتری از مسیر درمان و بازتوانی داشته باشند.
خطرات و عوارض احتمالی جراحی
هرچند جراحی قاعده جمجمه امروز با تکنیکهای اندوسکوپیک و ابزارهای ناوبری پیشرفته، یکی از کمتهاجمیترین و ایمنترین جراحیهای مغز محسوب میشود، اما واقعیت این است که هیچ مداخلهای در این ناحیه حساس کاملاً بیخطر نیست. نزدیکی محل جراحی به عصب بینایی، ساقهٔ مغز، شریان کاروتید، سینوس کاورنوس و غده هیپوفیز—یعنی همان مناطقی که در زندگی روزمره حتی میلیمترها تعیینکننده عملکرد حیاتی هستند—باعث میشود پیشبینی دقیق خطرات برای بیمار اهمیت بسیار زیادی داشته باشد.
یکی از شایعترین عوارض این جراحی نشت مایع مغزی–نخاعی (CSF Leak) است. هرچند میزان بروز آن حدود ۱ تا ۳ درصد گزارش میشود، اما ماهیت این عارضه حساس است؛ زیرا در صورت تداوم، مسیر صعودی برای عفونت فراهم میکند و باید سریع ترمیم شود. خوشبختانه تکنیکهای بازسازی امروزی—از جمله استفاده از فلپ نازوسپتوم و پریکوست—سبب شده احتمال آن بسیار کمتر از گذشته شود.
در دسته دوم، عفونت سینوسها یا مننژیت قرار میگیرد. وقتی جراح از مسیر بینی و سینوس اسفنوئید وارد جمجمه میشود، طبیعی است که احتمال التهاب موضعی یا عفونت خفیف سینوسی وجود داشته باشد. اما مننژیت، اگرچه بسیار نادر است، باید جدی گرفته شود. علت اهمیت این موضوع آن است که مننژ یک ساختار ظریف محافظتی است و هرگونه التهاب در این ناحیه میتواند با سردرد، تب یا سفتی گردن ظاهر شود. خبر خوب این است که رعایت تکنیک بازسازی صحیح و مصرف آنتیبیوتیک در موارد لازم، احتمال این عارضه را تقریباً به حد صفر نزدیک میکند.
در برخی بیماران، ممکن است اختلالات موقت بینایی یا حتی دوبینی ظاهر شود. دلیل آن نیز معمولاً تماس یا فشار موقت روی اعصاب حرکتی چشم (بهویژه عصبهای III و VI) یا کاهش تورم ناشی از فشردگی طولانیمدت عصب بینایی است. بیشتر این مشکلات طی روزها تا هفتهها برطرف میشوند و دائمی نیستند.
از طرفی، نزدیکی ابزارهای جراحی به عروق و اعصاب حیاتی، احتمال آسیب به شریان کاروتید یا اعصاب کرانیال را هرچند ناچیز، ولی مطرح میکند. این عارضه در مراکز تخصصی تقریباً نادر است، اما به دلیل اهمیت حیاتی ساختارهای اطراف، همیشه بخشی از گفتگوی صریح بین جراح و بیمار را تشکیل میدهد.
و در نهایت، جراحیهایی که در محدوده هیپوفیز انجام میشوند ممکن است باعث نارسایی هیپوفیز یا بروز دیابت بیمزه (Diabetes Insipidus) شوند. این وضعیت زمانی رخ میدهد که ارتباط طبیعی محور هیپوفیز–هیپوتالاموس دچار اختلال موقت یا دائمی شود. خوشبختانه اغلب موارد کوتاهمدت بوده و با تنظیم آبوالکترولیت و داروهای تخصصی کنترل میشود.
در ادامه، جدول «درصد وقوع» و «امکان پیشگیری» برای هر عارضه آورده شده است:
جدول خطرات و امکان پیشگیری
- نشت CSF: وقوع ۱ تا ۳ درصد – امکان پیشگیری بالا با بازسازی دقیق و فلپ نازوسپتوم
- عفونت سینوس/مننژیت: وقوع کمتر از ۱ درصد – امکان پیشگیری بسیار بالا با آنتیبیوتیک و ترمیم لایهها
- اختلالات بینایی موقت: وقوع حدود ۵ تا ۱۰ درصد – امکان پیشگیری متوسط (بستگی به اندازه و چسبندگی تومور)
- آسیب عصب یا عروق: وقوع کمتر از ۱ درصد – امکان پیشگیری بالا با ناوبری سهبعدی و اندوسکوپ زاویهدار
- دیابت بیمزه: وقوع ۲ تا ۵ درصد – امکان پیشگیری متوسط؛ درمانپذیر در اغلب بیماران
میزان موفقیت و پیشآگهی بیمار
نتایج جراحی قاعده جمجمه در دهه اخیر بهقدری دگرگون شده که امروز بسیاری از بیماران با آرامش میتوانند این مسیر را طی کنند و با کیفیتزندگی بسیار خوب به فعالیتهای روزمره بازگردند. ترکیب ابزارهای دقیق، تجربه تیم جراحی و تکنیکهای بازسازی پیشرفته—همگی سبب شدهاند میزان موفقیت این اعمال به یکی از بالاترین نرخها در حوزه جراحی مغز برسد.
برای مثال، در تومورهای خوشخیم مانند آدنومهای هیپوفیز، پوشکردن کامل توده معمولاً بیش از ۸۵ درصد موفقیت دارد. این عدد در مراکزی که حجم بالایی از جراحیهای اندوسکوپیک انجام میدهند، حتی بالاتر است. علت این نرخ موفقیت بالا آن است که اندوسکوپ با زاویههای ۳۰ و ۴۵ درجه، امکان مشاهده کامل حفره سلا و نواحی پشت تومور را فراهم میکند.
در بیماران هیپوفیزی، یکی از شاخصهای مهم موفقیت، بازگشت عملکرد هورمونی است. بسیاری از این بیماران پس از جراحی و کاهش فشار تومور روی هیپوفیز، طی حدود سه ماه وارد فاز بازیابی هورمونی میشوند. این مرحله گاهی با کمک دارو، و گاهی به اسکنهای پیگیری بستگی دارد.
در مورد بیماران دچار اختلالات بینایی، خبرهای امیدوارکننده فراوان است. وقتی تومور به عصب بینایی فشار آورده باشد، برداشتن توده مسیر انتقال سیگنال را آزاد میکند و طبق مطالعات بالینی، بیش از ۷۰ درصد بیماران بهبود بینایی را طی هفتهها تا ماههای پس از جراحی تجربه میکنند. این یکی از ملموسترین نشانههای اثرگذاری جراحی است—بهخصوص زمانی که بیمار قبل از عمل با محدودیت میدان دید وارد اتاق معاینه شده باشد.
پیشآگهی بلندمدت نیز بهشدت مطلوب است. عود تومور—بهویژه در تومورهای خوشخیم—معمولاً کمتر از ۱۰ درصد است. این عدد بسته به نوع تومور، سن بیمار، میزان برداشت و رفتار زیستی توده متفاوت است، اما میانگین عمومی همین مقدار گزارش میشود.
در نهایت، یکی از شاخصهای مهم برای بیمار، مدت زمان نقاهت است. در جراحیهای اندوسکوپی، بیمار معمولاً سریعتر از روشهای باز به زندگی روزمره بازمیگردد. روند معمول شامل یک دوره استراحت کوتاه، بهعلاوه مراقبتهای سینوسی و بینی است، و متوسط بازگشت به فعالیتهای سبک در دو تا چهار هفته اتفاق میافتد.
نمودار میانگین نقاهت و نرخ عود (در قالب توصیفی):
- هفته ۱ تا ۲: کاهش تدریجی درد، بهبود مسیر تنفسی بینی، افزایش انرژی
- هفته ۳ تا ۴: بازگشت به کارهای روزمره؛ محدودیت فعالیتهای سنگین
- ماه ۳: MRI پیگیری؛ اغلب بیماران به وضعیت پایدار هورمونی و عصبی میرسند
- نرخ عود: کمتر از ۱۰ درصد در افق ۳ تا ۵ سال
مقایسه کوتاه با سایر روشها
وقتی صحبت از جراحی قاعده جمجمه میشود، مهمترین پرسشی که اکثر بیماران و حتی برخی پزشکان دارند این است که: «تفاوت جراحی اندوسکوپیک با روشهای سنتی باز چیست؟»
پاسخ این سؤال، در واقع یک نگاه مقایسهای چندبعدی است—نگاهی که بهروشنی نشان میدهد چرا تکنیکهای اندوسکوپیک طی سالهای اخیر به انتخاب اول بسیاری از مراکز تخصصی تبدیل شدهاند.
در روش باز کلاسیک (کرانیوتومی سنتی)، جراح باید بخشی از استخوان جمجمه را کنار بزند تا به عمق مرکزی مغز و قاعده جمجمه برسد. این روش هرچند در برخی شرایط همچنان ضروری است—برای مثال تومورهای بسیار بزرگ یا گستردهای که فراتر از دسترس مسیر بینی هستند—اما طبیعتاً با دوره بستری طولانیتر، درد بیشتر و احتمال عوارض بالاتر همراه است. بیمار معمولاً ۷ تا ۱۰ روز بستری لازم دارد و نقاهت طولانیتر است؛ اتفاقی که نتیجه ورود از طریق بافتهای سالم و کنار زدن بافت مغزی است.
در مقابل، جراحی اندوسکوپیک قاعده جمجمه بدون برش خارجی، بدون دستکاری مغز، و از طریق مسیر طبیعی بینی انجام میشود. عدم نیاز به «باز کردن جمجمه» بزرگترین نقطه قوت این روش است. نتیجه چیست؟
- بستری ۲ تا ۳ روز
- نقاهت کوتاه و بازگشت سریع به زندگی روزمره
- احتمال عود کمتر به دلیل دسترسی بهتر به نقاط پنهان
- عوارض خفیفتر بهدلیل استفاده از اندوسکوپهای زاویهدار و مسیر کمتهاجمی
توصیف مقایسه به صورت جدول خوانا:
- جراحی باز کلاسیک: دارای برش جمجمه – بستری ۷ تا ۱۰ روز – احتمال عود متوسط – نقاهت طولانی – عوارض متوسط تا زیاد
- جراحی اندوسکوپیک: بدون برش جمجمه – بستری ۲ تا ۳ روز – احتمال عود پایین – نقاهت کوتاه – عوارض خفیف
برای مطالعه کاملتر این بخش و تکنیکهای نوین اندوسکوپیک، خواندن مقالهی زیر پیشنهاد میشود:
جراحی اندوسکوپیک قاعده جمجمه: تکنیکهای نوین بدون برش
سؤالات متداول (FAQ)
۱. آیا جراحی قاعده جمجمه خطرناک است؟
با وجود حساسیت بالا، در مراکز تخصصی و با تکنیک اندوسکوپیک، احتمال عوارض جدی کمتر از ۲ درصد است.
۲. آیا جای بخیه یا اسکار باقی میماند؟
خیر. مسیر ورود کاملاً از طریق بینی است و هیچ اثر ظاهری روی صورت یا پوست جمجمه نمیماند.
۳. آیا نیاز به بستری طولانی دارد؟
معمولاً ۲ تا ۳ روز کافی است. اکثر بیماران طی ۷ تا ۱۰ روز به فعالیت روزمره بازمیگردند.
۴. آیا امکان عود تومور وجود دارد؟
بله، اما با برداشت کامل توده و انجام MRI دورهای، احتمال عود در حدود کمتر از ۱۰ درصد است.
در پایان، باید گفت جراحی قاعده جمجمه یکی از دقیقترین و حساسترین حوزههای جراحی مغز است—اما در عین حال یکی از موفقترین.
ورود تکنیکهای اندوسکوپیک و ابزارهای تصویربرداری پیشرفته باعث شده امروز بتوان بسیاری از تومورها و ضایعات این ناحیه را بدون شکافت جمجمه، با حداقل عارضه، و با نقاهت بسیار کوتاهتر درمان کرد. این یک تحول واقعی در پزشکی مدرن است؛ تحولی که زندگی هزاران بیمار را تغییر داده است.
اگر میخواهید درک جامعتری از درمانهای مرتبط با مغز و ستون فقرات داشته باشید، خواندن مجموعه مقالات زیر پیشنهاد میشود:
- تومور هیپوفیز: درمان و جراحی آندوسکوپیک
- تنگی کانال نخاعی و جراحیهای کمتهاجمی
- شکستگی مهره کمر: علائم و مراقبتها
- ژنتراپی در تومورهای مغزی: امید تازه
و در نهایت—اگر شما یا بیمارانتان نیاز به ارزیابی دقیق تومور یا ضایعات قاعده جمجمه دارید، یا بهدنبال تصمیمگیری درباره بهترین گزینه کمتهاجمی هستید:
برای ارزیابی کامل پرونده، میتوانید با دکتر سعید اورعی یزدانی — فلوشیپ جراحی قاعده جمجمه و آندوسکوپی مغز — مشاوره تخصصی دریافت کنید.